A3 - Beeinflussung zentraler Rezeptoren über intranasale Applikation von Peptiden, die die Nahrungsaufnahme modulieren
Dieses Projekt untersucht die Mechanismen des Transfers von potentiellen Peptidtherapien in Zielstrukturen des zentralen Nervensystems über intranasale Applikationswege. Da im Hypothalamus, NPY-, Melanocortin 4- und Ghrelin-Rezeptoren stark exprimiert sind soll die Hypothese getestet werden, dass die entsprechenden Peptide entweder allein oder in Kombination zur Modulation der Nahrungsaufnahme führen. Im Projekt soll außerdem der intranasale Applikationsweg im Hinblick auf die zentralen Transportwege (z. B. axonal oder venös) und die Beinflussbarkeit dieser Transportmechanismen über chemische Modifikationen der Peptide besser verstanden werden. Es soll im Projekt herausgefunden werden, welche Hirnareale über intranasale Applikationswege adressiert werden können und ob dies für die Kandidatenmoleküle eine Therapiestrategie zur Modulation der Nahrungsaufnahme sein kann. Dazu sollen intranasale mit subkutaner und zentraler Applikation in geeigneten Tiermodellen verglichen werden.
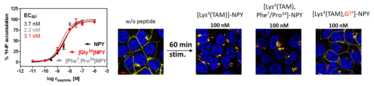
Abbildung 1: Charakterisierung der Liganden NPY, [F7,P34] NPY und [Gly34] NPY. Links: Alle Peptide zeigen eine vergleichbare G-Protein Aktivierung. Rechts: HEK293 Zellen, die stabil Y1-YFP Fusionsproteine (gelb) exprimieren. Nach Inkubation mit den verschiedenen TAM-markierten Peptiden (rot) für 60 min ist eine unterschiedliche Rezeptorinternalisierung zu beobachten. (TAM: Tetramethylrhodamine). Zellkerne sind blau gefärbt.
Ziffert I, Kaiser A, Hoppenz P, Mörl K, Beck-Sickinger AG. Shuttling of Peptide-Drug Conjugates by G Protein-coupled Receptors is Significantly Improved by Pulsed Application. ChemMedChem. 2020 Jul 22.
Ziffert I, Kaiser A, Babilon S, Mörl K, Beck-Sickinger AG. Unusually persistent Gαi-signaling of the neuropeptide Y2 receptor depletes cellular Gi/o pools and leads to a Gi-refractory state. Cell Commun Signal. 2020 Mar 30;18(1):49.
Krieg L, Schaffert A, Kern M, Landgraf K, Wabitsch M, Beck-Sickinger AG, Koerner A, Blüher M, von Bergen M, Schubert K. An MRM-Based Multiplexed Quantification Assay for Human Adipokines and Apolipoproteins. Molecules. 2020 Feb 11;25(4). pii: E775.
Wittrisch S, Klöting N, Mörl K, Chakaroun R, Blüher M, Beck-Sickinger AG. NPY1R-targeted peptide-mediated delivery of a dual PPARα/γ agonist to adipocytes enhances adipogenesis and prevents diabetes progression. Mol Metab. 2020 Jan;31:163-180.
Kaiser A, Wanka L, Ziffert I, Beck-Sickinger AG. Biased agonists at the human Y1 receptor lead to prolonged membrane residency and extended receptor G protein interaction. Cell Mol Life Sci. 2020 Jan 9. doi: 10.1007/s00018-019-03432-7.
Hoppenz P, Els-Heindl S, Beck-Sickinger AG. Identification and stabilization of a highly selective gastrin-releasing peptide receptor agonist. J Pept Sci. 2019 Nov 19:e3224. Epub ahead of print
Kögler LM, Stichel J, Kaiser A, Beck-Sickinger AG. Cell-Free Expression and Photo-Crosslinking of the Human Neuropeptide Y2 Receptor. Front Pharmacol. 2019 Mar 1;10:176.
Wanka L, Babilon S, Kaiser A, Mörl K, Beck-Sickinger AG.Different mode of arrestin-3 binding at the human Y1 and Y2 receptor.Cell Signal. 2018 Jun 23. pii: S0898-6568(18)30130-X.
Yang Z, Han S, Keller M, Kaiser A, Bender BJ, Bosse M, Burkert K, Kögler LM, Wifling D, Bernhardt G, Plank N, Littmann T, Schmidt P, Yi C, Li B, Ye S, Zhang R, Xu B, Larhammar D, Stevens RC, Huster D, Meiler J, Zhao Q, Beck-Sickinger AG, Buschauer A, Wu B. Structural basis of ligand binding modes at the neuropeptide Y Y1 receptor. Nature. 2018 Apr;556(7702):520-524.
Burkert K, Zellmann T, Meier R, Kaiser A, Stichel J, Meiler J, Mittapalli GK, Roberts E, Beck-Sickinger AG. A Deep Hydrophobic Binding Cavity is the Main Interaction for Different Y(2) R Antagonists. ChemMedChem. 2016; Epub ahead of print.
Wanka L, Babilon S, Burkert K, Mörl K, Gurevich VV, Beck-Sickinger AG. C-terminal motif of human neuropeptide Y4 receptor determines internalization and arrestin recruitment. Cell Signal. 2017;29:233-9.
Thieme V, Jolly N, Madsen AN, Bellmann-Sickert K, Schwartz TW, Holst B, Cox HM,Beck-Sickinger AG. High molecular weight PEGylation of human pancreatic polypeptide at position 22 improves stability and reduces food intake in mice. Br J Pharmacol. 2016; Epub ahead of print.
Park M, Sivertsen BB, Els-Heindl S, Huber T, Holst B, Beck-Sickinger AG, Schwartz TW, Sakmar TP. Bioorthogonal labeling of ghrelin receptor to facilitate studies of ligand-dependent conformational dynamics. Chem Biol. 2015;22:1431-6.
Kaiser A, Müller P, Zellmann T, Scheidt HA, Thomas L, Bosse M, Meier R, Meiler J, Huster D, Beck-Sickinger AG, Schmit P. Unwinding of the C-terminal residues of neuropeptide Y is critical for Y2 receptor binding and activation. Angew Chem Int Ed Engl. 2015;54:7446-9.
Kilian TM, Klöting N, Bergmann R, Els-Heindl S, Babilon S, Clement-Ziza M, Zhang Y, Beck-Sickinger AG, Chollet C. Rational design of dual peptides targeting ghrelin and Y2 receptors to regulate food intake and body weight. J Med Chem. 2015;58:4180-9.
Kostelnik KB, Els-Heindl S, Klöting N, Baumann S, von Bergen M, Beck-Sickinger AG. High metabolic in vivo stability and bioavailability of a palmitoylated ghrelin receptor ligand assessed by mass spectrometry. Bioorg Med Chem. 2015;23:3925-32.
Rojas JM, Bruinstroop E, Printz RL, Alijagic-Boers A, Foppen E, Turney MK, George L, Beck-Sickinger AG, Kalsbeek A, Niswender KD. entral nervous system neuropeptide Y regulates mediators of hepatic phospholipid remodeling and very low-density lipoprotein triglyceride secretion via sympathetic innervation. Mol Metab. 2015;4:210-21.
Pedragosa-Badia X, Sliwoski GR, Dong Nguyen E, Lindner D, Stichel J, Kaufmann KW, Meiler J, Beck-Sickinger AG. Pancreatic polypeptide is recognized by two hydrophobic domains onf the human Y4 receptor binding pockelt. J Biol Chem. 2014;289:5846-59.
Diaz Gimenez LE, Babilon S, Wanka L, Beck-Sickinger AG, Gurevich VV. Mutations in arrestin-3 differentially affect binding to neuropeptide Y receptor subtypes. Cell Signal. 2014;26:1523-31.
Mäde V, Bellmann-Sickert K, Kaiser A, Meiler J, Beck-Sickinger AG. Position and length of fatty acids strongly affect receptor selectivity pattern of human pancreatic polypeptide analogues. ChemMedChem. 2014;9:2463-74.
Mäde V, Babilon S, Jolly N, Wanka L, Bellmann-Sickert K, Diaz Gimenez LE, Mörl K, Cox HM, Gurevich VV, Beck-Sickinger AG. Peptide modifications differentially alter G protein-coupled receptor internalization and signaling bias. Angew Chem Int Ed. 2014;53:10067-71.
Mäde V, Els-Heindl S, Beck-Sickinger AG. Automated solid-phase peptide synthesis to obtain therapeutic peptides. Beilstein J Org Chem. 2014;110:1197-212.
Klöting N, Kovacs P, Kern M, Heiker JT, Fasshauer M, Schön MR, Stumvoll M, Beck-Sickinger AG, Blüher M. Central vaspin administration acutely reduces food intake and has sustained blood glucose-lowering effects. Diabetologia. 2011;54:1819-23.
Böhme I, Stichel J, Walther C, Mörl K, Beck-Sickinger AG. Agonist induced receptor internalization of neuropeptide Y receptor subtypes depends on third intracellular loop and C-terminus. Cell Signal. 2008;20:1740-9.
Walther C, Nagel S, Gimenez LE, Mörl K, Gurevich VV, Beck-Sickinger AG. Ligand-induced internalization and recycling of the human neuropeptide Y2 receptor is regulated by its carboxyl-terminal tail. J Biol Chem. 2010;285:41578-90.
Khan IU, Zwanziger D, Böhme I, Javed M, Naseer H, Hyder SW, Beck-Sickinger AG. Breast-cancer diagnosis by neuropeptide Y analogues: from synthesis to clinical application. Angew Chem Int Ed Engl. 2010;49:1155-8.
Keller M, Pop N, Hutzler C, Beck-Sickinger AG, Bernhardt G, Buschauer A. Guanidine-acylguanidinebioisosteric approach in the design of radioligands: synthesis of a tritium-labeled N(G)-propionylargininamide ([3H]-UR-MK114) as a highly potent and selective neuropeptide Y Y1 receptor antagonist. J Med Chem. 2008;51:8168-72.
Lindner D, van Dieck J, Merten N, Mörl K, Günther R, Hofmann HJ, Beck-Sickinger AG. GPC receptors and not ligands decide the binding mode in neuropeptide Y multireceptor/multiligand system. Biochemistry. 2008;47:5905-14.
Merten N, Lindner D, Rabe N, Römpler H, Mörl K, Schöneberg T, Beck-Sickinger AG. Receptor subtype-specific docking of Asp6.59 with C-terminal arginine residues in Y receptor ligands. J Biol Chem. 2007;282:7543-51.
Dinger MC, Bader JE, Kobor AD, Kretzschmar AK, Beck-Sickinger AG. Homodimerization of neuropeptide y receptors investigated by fluorescence resonance energy transfer in living cells. J Biol Chem. 2003;278:10562-71.

Doktorandin
Mareike Schenk
| Adresse (Büro): | Fakultät für Lebenswissenschaften, Institut für Biochemie, Brüderstraße 34, 04103 Leipzig |
|
Tel.: (Labor/ Büro):
E-Mail:
|
0341 / 9736904
mareike.schenk@uni-leipzig.de
|
|
Thema des Promotionsprojekts:
|
|
Doktorandin
Eva-Maria Jülke
| Adresse (Büro): | Fakultät für Lebenswissenschaften, Institut für Biochemie, Brüderstraße 34, 04103 Leipzig |
|
Tel.: (Labor/ Büro):
E-Mail:
|
0341 / 9736904
e.juelke@uni-leipzig.de
|
|
Thema des Promotionsprojekts:
|
|