B6 - Mechano-sensitive Adhäsions-GPCRs im Fettgewebe
In diesem Projekt werden wir die Hypothese testen ob Adhäsions-GPCR (aGPCR) auch in vivo die Differenzierung und den Metabolismus von Adipozyten regulieren können. Dazu werden wir i) Signalwege von aGPCR nach Mechanoaktivierung analysieren ii) deren funktionelle Relevanz in Adipozyten studieren und iii) die in vivo Relevanz von mechano-sensitiven aGPCR in Adipozyten in Mäusen und dem Menschen untersuchen. Dies erfolgt mittels live Imaging, Atomic force Microscopy und aGPCR-defizienten Tiermodellen. In einem translationalen Ansatz werden wir Menschen, die Funktions-defiziente Varianten von aGPCR in sich tragen, identifizieren, diese im klinischen Umfeld des SFB näher charakterisieren und aGPCR als mögliche therapeutische Targets bei Adipositas testen.
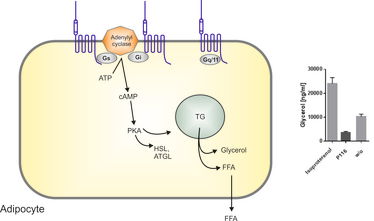
Abbildung 1: Adhäsions-G-Protein-gekoppelte Rezeptoren (aGPCRs) modulieren die Adipozytenfunktion. Verschiedene Mitglieder der aGPCR-Familie wurden idenfiziert als differenziell reguliert in Adipozyten und Fettgewebe. Wir schlagen vor, dass aGPCRs die Adipozytenfunktion und die Fettsäurezusammensetzung modifizieren können durch G-Protein-vermittelte Funktionen in vitro und in vivo.
PKA: Proteinkinase A, HSL: hormonsensitive Lipase, ATGL: Adipozyten-Triglycerid-Lipase, TG: Triglyzerid, FFA: freie Fettsäure, p116: agonistisches Peptid von GPR116 (ein aGPCR, der im Fettgewebe endogen exprimiert wird), w/o: ohne.
Kaczmarek I, Suchý T, Prömel S, Schöneberg T, Liebscher I, Thor D. The relevance of adhesion G protein-coupled receptors in metabolic functions.Biol Chem. 2021 Jul 5.
Frenster JD, Stephan G, Ravn-Boess N, Bready D, Wilcox J, Kieslich B, Wilde C, Sträter N, Wiggin GR, Liebscher I, Schöneberg T, Placantonakis DG. Functional impact of intramolecular cleavage and dissociation of adhesion G protein-coupled receptor GPR133 (ADGRD1) on canonical signaling. J Biol Chem. 2021 May 19:100798.
Georgiadi A, Lopez-Salazar V, Merahbi RE, Karikari RA, Ma X, Mourão A, Klepac K, Bühler L, Alfaro AJ, Kaczmarek I, Linford A, Bosma M, Shilkova O, Ritvos O, Nakamura N, Hirose S, Lassi M, Teperino R, Machado J, Scheideler M, Dietrich A, Geerlof A, Feuchtinger A, Blutke A, Fischer K, Müller TD, Kessler K, Schöneberg T, Thor D, Hornemann S, Kruse M, Nawroth P, Pivovarova-Ramich O, Pfeiffer AFH, Sattler M, Blüher M, Herzig S. Orphan GPR116 mediates the insulin sensitizing effects of the hepatokine FNDC4 in adipose tissue. Nat Commun. 2021 May 20;12(1):2999.
Favara DM, Liebscher I, Jazayeri A, Nambiar M, Sheldon H, Banham AH, Harris AL. Elevated expression of the adhesion GPCR ADGRL4/ELTD1 promotes endothelial sprouting angiogenesis without activating canonical GPCR signalling. Sci Rep. 2021 Apr 23;11(1):8870.
Schöneberg T, Liebscher I. Mutations in G Protein-Coupled Receptors: Mechanisms, Pathophysiology and Potential Therapeutic Approaches. Pharmacol Rev. 2021 Jan;73(1):89-119.
Le Duc D, Lin CC, Popkova Y, Yang Z, Akhil V, Çakir MV, Grunewald S, Simon JC, Dietz A, Dannenberger D, Garten A, Lemke JR, Schiller J, Blüher M, Nono Nankam PA, Rolle-Kampczyk U, von Bergen M, Kelso J, Schöneberg T. Reduced lipolysis in lipoma phenocopies lipid accumulation in obesity. Int J Obes (Lond). 2020 Nov 24.
Jäger E, Murthy S, Schmidt C, Hahn M, Strobel S, Peters A, Stäubert C, Sungur P, Venus T, Geisler M, Radusheva V, Raps S, Rothe K, Scholz R, Jung S, Wagner S, Pierer M, Seifert O, Chang W, Estrela-Lopis I, Raulien N, Krohn K, Sträter N, Hoeppener S, Schöneberg T, Rossol M, Wagner U. Calcium-sensing receptor-mediated NLRP3 inflammasome response to calciprotein particles drives inflammation in rheumatoid arthritis. Nat Commun. 2020 Aug 25;11(1):4243.
Frenster JD, Kader M, Kamen S, Sun J, Chiriboga L, Serrano J, Bready D, Golub D, Ravn-Boess N, Stephan G, Chi AS, Kurz SC, Jain R, Park CY, Fenyo D, Liebscher I, Schöneberg T, Wiggin G, Newman R, Barnes M, Dickson JK, MacNeil DJ, Huang X, Shohdy N, Snuderl M, Zagzag D, Placantonakis DG. Expression profiling of the adhesion G protein-coupled receptor GPR133 (ADGRD1) in glioma subtypes. Neurooncol Adv. 2020 Apr 28;2(1):vdaa053.
Suchý T, Zieschang C, Popkova Y, Kaczmarek I, Weiner J, Liebing AD, Çakir MV, Landgraf K, Gericke M, Pospisilik JA, Körner A, Heiker JT, Dannenberger D, Schiller J, Schöneberg T, Liebscher I, Thor D. The repertoire of Adhesion G protein-coupled receptors in adipocytes and their functional relevance. Int J Obes (Lond). 2020 Mar 19.
Peters A, Rabe P, Krumbholz P, Kalwa H, Kraft R, Schöneberg T, Stäubert C. Natural biased signaling of hydroxycarboxylic acid receptor 3 and G protein-coupled receptor 84. Cell Commun Signal. 2020 Feb 26;18(1):31.
Röthe J, Kraft R, Schöneberg T, Thor D. Exploring G Protein-Coupled Receptor Signaling in Primary Pancreatic Islets. Biol Proced Online. 2020 Feb 15;22:4.
Leppert B, Strunz S, Seiwert B, Schlittenbauer L, Schlichting R, Pfeiffer C, Röder S, Bauer M, Borte M, Stangl GI, Schöneberg T, Schulz A, Karkossa I, Rolle-Kampczyk UE, Thürmann L, von Bergen M, Escher BI, Junge KM, Reemtsma T, Lehmann I, Polte T. Maternal paraben exposure triggers childhood overweight development. Nat Commun. 2020 Feb 11;11(1):561.
Jacobson KA, Delicado EG, Gachet C, Kennedy C, von Kügelgen I, Li B, Miras-Portugal MT, Novak I, Schöneberg T, Perez-Sen R, Thor D, Wu B, Yang Z, Müller CE. Update of P2Y Receptor Pharmacology: IUPHAR Review:27. Br J Pharmacol. 2020 Feb 9.
Bradley EC, Cunningham RL, Wilde C, Morgan RK, Klug EA, Letcher SM, Schöneberg T, Monk KR, Liebscher I, Petersen SC. In vivo identification of small molecules mediating Gpr126/Adgrg6 signaling during Schwann cell development., Ann N Y Acad Sci. 2019 Sep 16.
Eichler W, Lohrenz A, Simon KU, Krohn S, Lange J, Bürger S, Liebscher I. The role of ADGRE5/CD97 in human retinal pigment epithelial cell growth and survival. Ann N Y Acad Sci. 2019 Aug 9.
Scholz N, Langenhan T, Schöneberg T. Revisiting the classification of adhesion GPCRs. Ann N Y Acad Sci. 2019 Jul 31.
Knierim AB, Röthe J, Çakir MV, Lede V, Wilde C, Liebscher I, Thor D, Schöneberg T. Genetic basis of functional variability in adhesion G protein-coupled receptors. Sci Rep. 2019 Jul 30;9(1):11036
Röthe J, Thor D, Winkler J, Knierim AB, Binder C, Huth S, Kraft R, Rothemund S, Schöneberg T, Prömel S. Involvement of the Adhesion GPCRs Latrophilins in the Regulation of Insulin Release. Cell Rep. 2019 Feb 5;26(6):1573-1584.
Schöneberg T, Prömel S. Latrophilins and Teneurins in Invertebrates: No Love for Each Other? Front. Neurosci., 12 March 2019
Schöneberg T, Meister J, Knierim AB, Schulz A. The G protein-coupled receptor GPR34 - The past 20 years of a grownup. Pharmacol Ther. 2018 Apr 22. pii: S0163-7258(18)30071-8.
Lede V, Meusel A, Garten A, Popkova Y, Penke M, Franke C, Ricken A, Schulz A, Kiess W, Huster D, Schöneberg T, Schiller J. Altered hepatic lipid metabolism in mice lacking both the melanocortin type 4 receptor and low density lipoprotein receptor. PLoS One. 2017;12:e0172000.
Lede V, Franke C, Meusel A, Teupser D, Ricken A, Thiery J, Schiller J, Huster D, Schöneberg T, Schulz A. Severe atherosclerosis and hypercholesterolemia in mice lacking both the melanocortin type 4 receptor and low density lipoprotein receptor. PLoS One. 2016;11:e0167888.
Sträter N, Marek S, Kuettner EB, Kloos M, Keim A, Brüser A, Kirchberger J, Schöneberg T. Molecular architecture and structural basis of allosteric regulation of eukaryotic phosphofructokinases. FASEB J. 2011;25:89-98.
Bohnekamp J, Schöneberg T. Cell adhesion receptor GPR133 couples to Gs protein. J Biol Chem. 2011; 286: 41912-6.
Engel KMY, Schröck K, Teupser D, Holdt LM, Tönjes A, Kern M, Dietrich K, Kovacs P, Krügel U, Scheidt HA, Schiller J, Huster D, Brockmann GA, Augustin M, Thiery J, Blüher M, Stumvoll M, Schöneberg T, Schulz A. Reduced food intake and body weight in mice deficient for the G protein-coupled receptor GPR82. PLoS One. 2011;6:e29400.
Stäubert C, Tarnow P, Brumm H, Pitra C, Gudermann T, Grüters A, Schöneberg T, Biebermann H, Römpler H. Evolutionary aspects in evaluating mutations in the melanocortin 4 receptor. Endocrinology. 2007;148:4642-8.
Doktorandin
Isabell Kaczmarek
|
Adresse (Büro):
|
Raum Nr. D306, Rudolf Schönheimer Institut für Biochemie, Johannisallee 30, 04103 Leipzig
|
|
Tel. (Labor/ Büro):
E-mail:
|
0341 9722177
|
|
Thema des Promotionsprojekts:
|
|


Doktorandin
Tomáš Suchý
|
Adresse (Büro):
|
Rudolf-Schönheimer-Institut für Biochemie, Johannisallee 30, 04103 Leipzig
|
|
Tel. (Labor/ Büro):
E-mail:
|
0341 9722152
|
| Thema des Promotionsprojekts: |
Christina ist Doktorandin in der Gruppe von Dr. Susanne Horn am Rudolf-Schönheimer-Institut. Hier entwickelt sie machine learning Modelle in Python für die Vorhersage von klinischen Ergebnissen aus Hochdurchsatz-Sequenzierungsdaten. Diese werden eingesetzt, um die Eigenschaften von Melanom-Tumorproben während der Immun-Checkpoint-Inhibition zu entschlüsseln.
|