Hepatische Lipidakkumulation in Mausmodellen der Adipositas
Dieses Projekt wurde von 2013 bis 2016 im Rahmen des SFB 1052 von der Deutschen Forschungsgemeinschaft gefördert.
Projektbeschreibung der 1. Förderphase:
Adipositas ist oft von Insulinresistenz, Bluthochdruck und Änderungen der Lipidzusammensetzung des Plasmas begleitet, was man auch als "metabolisches Syndrom" bezeichnet. Diese Prozesse haben auch Auswirkungen auf den Lipidstoffwechsel in der Leber. In früheren Arbeiten konnten wir einen genetisch-veränderten Mausstamm etablieren, bei dem sowohl der "Melanocortin-4-Rezeptor" (MC4R) wie auch der "Low-Density Lipoprotein (LDL) Rezeptor" ausgeschaltet sind. Diese Mäuse etwickeln metabolisches Syndrom sowie Hyperlipoproteinämie und weisen ein Lipoprotein-Profil auf, das denen adipöser Patienten ähnelt. Zudem entwickelt dieser Mausstamm innerhalb von 6 Monaten eine Hepatostatose und eine Arteriosklerose. Dies geschieht bereits bei normaler Fütterung ohne dass hohe Menge an Cholesterol im Futter vorhanden sein müssen. Dieses Mausmodell soll deshalb verwendet werden um die Mechanismen, die zu den bekannten Folgeerscheinungen einer Adipositas führen (insbesondere im Hinblick auf den Leber-Lipidstoffwechsel), näher zu untersuchen.
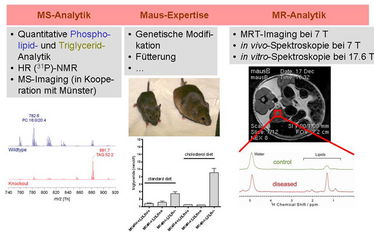
Eine zentrale Frage ist, ob es signifikante Unterschiede im Transkriptom bzw. im Lipidom gibt und wie diese mit den Pathomechanismen der Adipositas-assoziierten Hepatosteatose in Zusammenhang stehen. LDLR- und LDLR/MC4R-defiziente Mäuse (wie auch andere Mausmodelle) sollen deshalb auf Unterschiede in Abhängigkeit von den Fütterungsbedingungen untersucht werden. Das "Profiling" möglicher Veränderungen im hepatischen Transkriptom und dem Lipid-Metabolom wird mittels RNA-Sequenzierung und Massenspektrometrie (Bestimmung der einzelnen Lipidklassen und der jeweiligen Fettsäurezusammensetzungen) sowie (hochauflösender) NMR-Spektroskopie in Lösung und im Festkörper - zur Bestimmung des Wasseranteils und der Anteile der einzelnen Lipidspezies - erfolgen. Wir erhoffen uns aus diesen Untersuchungen ein verbessertes Verständnis über die Signalwege und die initialen Ereignisse, die schließlich zur Hepatitis und zur Hepatosteatose, sowohl im Mausmodell wie auch beim adipösen Menschen, führen. Wir erwarten insbesondere, dass die verschiedenen analytischen Verfahren und Mausmodelle Aufschluss über die Rolle von Lipidoxidationsprodukten bei der Pathogenese und u.U. die Therapierbarkeit der Hepatosteatose ergeben. Zusätzlich zu den Untersuchungen an Biopsaten wollen wir auch die MR-Tomographie bei hohen Feldstärken (7 Tesla) einsetzen um das Fett- und Lebergewebe unter in vivo-Bedingungen mit hoher räumlicher Auflösung zu untersuchen.
Abbildung 1: Modell für die Entstehung der Fehlfunktion des Fettgewebes.
Schöneberg T, Meister J, Knierim AB, Schulz A. The G protein-coupled receptor GPR34 - The past 20 years of a grownup. Pharmacol Ther. 2018 Apr 22. pii: S0163-7258(18)30071-8.
Lede V, Meusel A, Garten A, Popkova Y, Penke M, Franke C, Ricken A, Schulz A, Kiess W, Huster D, Schöneberg T, Schiller J. Altered hepatic lipid metabolism in mice lacking both the melanocortin type 4 receptor and low density lipoprotein receptor. PLoS One. 2017;12:e0172000.
Popkova Y, Schiller J. TAG suppression by CsCl addition. Rapid Commun Mass Spetrom. 2017;31:411-8.
Engel KM, Schiller J. A comparison of PC oxidation products as detected by MALDI-TOF and ESI-IT mass spectrometry. Chem Phys Lipids. 2017;203:33-45.
Schröter J, Schiller J. Chlorinated phospholipids and fatty acids: (patho)physiological relevance, potential toxicity, and analysis of lipid chlorohydrins. Oxid Med Cell Longev. 2016;2016:8386362.
Lede V, Franke C, Meusel A, Teupser D, Ricken A, Thiery J, Schiller J, Huster D, Schöneberg T, Schulz A. Severe atherosclerosis and hypercholesterolemia in mice lacking both the melanocortin type 4 receptor and low density lipoprotein receptor. PLoS One. 2016;11:e0167888.
Stelzner K, Herbert D, Popkova Y, Lorz A, Schiller J, Gericke M, Klöting N, Blüher M, Franz S, Simon JC, Saalbach A. Free fatty acids sensitize dendritic cells to amplify TH1/TH17-immune responses. Eur J Immunol. 2016;46:2043-53.
Schröter J, Griesinger H, Reuß E, Schulz M, Riemer T, Süß R, Schiller J, Fuchs B. Unexpected products of the hypochlorous acid-induced oxidation of oleic acid: A study using high performance thin-layer chromatography-electrospray ionization mass spectrometry. J Chromatogr A. 2016;1439:89-96.
Popkova Y, Meusel A, Breitfeld J, Schleinitz D, Hirrlinger J, Dannenberger D, Kovacs P, Schiller J. Nutrition-dependent changes of mouse adipose tissue compositions monitored by NMR, MS, and chromatographic methods. Anal Bioanal Chem. 2015;407:5113-23.
Griesinger H, Fuchs B, Süß R, Matheis K, Schulz M, Schiller J. The thicknesses of the stationary phase determines the quality of TLC/MALDI mass spectra of lipids. Anal Biochem. 2014;451:45-7.
Jaskolla TW, Onischke K, Schiller J. 2,5-dihydroxybenzoic acid salts for matrix-assisted laser desorption/ionizatioin time-of-flight mass spectrometric lipid analysis: Simplified spectra interpretation and insights into gasphase fragmentation. Rapid Commun Mass Spetrom. 2014;28:1353-63.
Zschörnig K, Schiller J. A simple method to generate oxidized phosphatidylcholines im amounts close to one milligram. Chem Phys Lipids. 2014;184:30-7.
Eibisch M, Popkova Y, Süß R, Schiller J, Dannenberger D. Evaluation of a commercial enzymatic test kit regarding the quantitative analysis of different free fatty acids. Anal Bioanal Chem. 2014;406:7410-5.
Pirkl A, Meier M, Popkova Y, Letzel M, Schnapp A, Schiller J, Dreisewerd K. Analysis of free fatty acids by ultraviolet laser desorption ionization mass spectrometry using insect wings as hydrophobic sample substrates. Anal Chem. 2014;86:10763-71.
Scheidt HA, Meyer T, Nikolaus J, Baek DJ, Haralampiev I, Thomas L, Bittmann R, Müller P, Herrmann A, Huster D. Cholesterol[1]s Aliphatic Side Chain Modulates Membrane Properties. Angew Chem Int Ed. 2013;52:12848–51.
Weber F, Böhme J, Scheidt HA, Gründer W, Rammelt S, Hacker M, Schulz-Siegmund M, Huster D. 31P and 13C solid-state NMR spectroscopy to study collagen synthesis and biomineralization in polymer-based bone implants. NMR Biomed. 2012;25:464-75.
Fuchs B, Süß R, Teuber K, Eibisch M, Schiller J. Application of TLC to the analysis of lipids. J Chromatogr A. 2011;1218:2754-74.
Sträter N, Marek S, Kuettner EB, Kloos M, Keim A, Brüser A, Kirchberger J, Schöneberg T. Molecular architecture and structural basis of allosteric regulation of eukaryotic phosphofructokinases. FASEB J. 2011;25:89-98.
Bohnekamp J, Schöneberg T. Cell adhesion receptor GPR133 couples to Gs protein. J Biol Chem. 2011; 286: 41912-6.
Engel KMY, Schröck K, Teupser D, Holdt LM, Tönjes A, Kern M, Dietrich K, Kovacs P, Krügel U, Scheidt HA, Schiller J, Huster D, Brockmann GA, Augustin M, Thiery J, Blüher M, Stumvoll M, Schöneberg T, Schulz A. Reduced food intake and body weight in mice deficient for the G protein-coupled receptor GPR82. PLoS One. 2011;6:e29400.
Fuchs B, Süß R, Schiller J. An update of MALDI-TOF mass spectrometry in lipid research. Progr Lipid Res. 2010;49:450-75.
Jaskolla T, Fuchs B, Karas M, Schiller J. The new matrix 4-chloro-α-cyanocinnamic acid allows the detection of phosphatidylethanolamine chloramines by MALDI-TOF mass spectrometry. J Am Soc Mass Spectrom. 2009;20:867-74.
Richter G, Schober C, Süß R, Fuchs B, Birkemeyer C, Schiller J. Comparison of the positive and negative ion electrospray ionization and matrix-assisted laser desorption and ionization time-of-flight mass spectra of the reaction products of phosphatidylethanolamines and hypochlorous acid. Anal Biochem. 2008;376:157-9.
Bunge A, Müller P, Stöckl M, Herrmann A, Huster D. Characterization of the ternary mixture of sphingomyelin, POPC, and cholesterol. Support for an inhomogeneous lipid distribution at high temperature. Biophys J. 2008;94:2680-90.
Stäubert C, Tarnow P, Brumm H, Pitra C, Gudermann T, Grüters A, Schöneberg T, Biebermann H, Römpler H. Evolutionary aspects in evaluating mutations in the melanocortin 4 receptor. Endocrinology. 2007;148:4642-8.
Huster D, Scheidt HA, Arnold K, Herrmann A, Müller P. Desmosterol may replace cholesterol in biological membranes. Biophys J. 2005;88:1838-44.
Huster D, Arnold K, Gawrisch K, Influence of docosahexaenoic acid and cholesterol on lateral lipid organization in phospholipid membranes. Biochemistry. 1998;37:17299-308.
PROJEKT TEAM
|
Prof. Dr. Torsten Schöneberg |
PD Dr. Jürgen Schiller |
Prof. Dr. Daniel Huster |