A7 - Das Endocannabinoid-System im Nucleus arcuatus des Hypothalamus: Identifizierung neuer Mechanismen der Energiehomöostase-Regulation
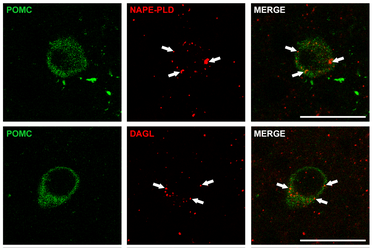
Abbildung 1: Immunofluoreszenz in transgenen POMC-GFP Reporter Mäusen. POMC Neurone (in grün) exprimieren spezifische Enzyme zur Biosynthese von Endocannabinoiden, wie NAPE-PLD (oben: in rot, Pfeile) und DAGL (unten: in rot, Pfeile). Balken = 25 mm.
García-Cáceres C, Balland E, Prevot V, Luquet S, Woods SC, Koch M, Horvath TL, Yi CX, Chowen JA, Verkhratsky A, Araque A, Bechmann I, Tschöp MH. Role of astrocytes, microglia, and tanycytes in brain control of systemic metabolism. Nat Neurosci. 2019 Jan;22(1):7-14.
Horn H, Böhme B, Dietrich L, Koch M. Endocannabinoids in Body Weight Control. Pharmaceuticals (Basel). 2018 May 30;11(2).
Quarta C, Clemmensen C, Zhu Z, Yang B, Joseph SS, Lutter D, Yi CX, Graf E, García-Cáceres C, Legutko B, Fischer K, Brommage R, Zizzari P, Franklin BS, Krueger M, Koch M, Vettorazzi S, Li P, Hofmann SM, Bakhti M, Bastidas-Ponce A, Lickert H, Strom TM, Gailus-Durner V, Bechmann I, Perez-Tilve D, Tuckermann J, Hrabě de Angelis M, Sandoval D, Cota D, Latz E, Seeley RJ, Müller TD, DiMarchi RD, Finan B, Tschöp MH. Molecular Integration of Incretin and Glucocorticoid Action Reverses Immunometabolic Dysfunction and Obesity. Cell Metab. 2017;26:620-32.
Koch M. Cannabinoid receptor signaling in central regulation of feeding behavior: a mini-review. Front Neurosci. 2017;11:293.
Morozov YM, Koch M, Rakic P, Horvath TL. Cannabinoid type 1 receptor-containing axons innervate hunger-promoting AgRP/NPY neurons in the mouse arcuate nucleus. Mol Metabol. 2017;6:374-81.
Jin S, Kim JK, Kim KK, Park JW, Koch M, Horvath TL, Lee BJ. Hypothalamic TLR2 triggers sickness behavior via a microglia-neuronal axis. Sci Rep. 2016;6:29424.
Horvath TL, Kim JG, Sun BH, Dietrich MO, Koch M, Yao GQ, Diano S, Insogna K. AgRP neurons regulate bone homeostasis. Cell Rep. 2015;13:8-14.
Koch M, Ferreirós N, Geisslinger G, Dehghani, Korf HW. Rhythmic control of endocannabinoids in the rat pineal gland. Chronobiol Int. 2015;10:1-6.
Koch M, Varela L, Kim JG, Kim JD, Hernández-Nuño F, Simonds SE, Castorena CM, Vianna CR, Elmquist JK, Morozov YM, Rakic P, Bechmann I, Cowley MA, Szigeti-Buck K, Gao X-B, Dietrich MO, Diano S, Horvath TL. Hypothalamic POMC neurons promote cannabinoid-induced feeding. Nature. 2015;519:45-50.
Kim JG, Suyama S, Koch M, Szigeti K, Gao Y, Garcia-Caceres C, Yi CX, Chowen J, Tschop MH, Horvath TL. Leptin receptors in astrocytes control synaptic input organization of melanocortin cells and metabolic adaptations. Nat Neurosci. 2014;17:908-10.
Koch M, Horvath TL. Neuronal circuitries that regulate food intake and energy metabolism. Mol Psychiatry. 2014;9:752-61.
Kallendrusch S, Kremzow S, Nowicki M, Hobusch C, Merkwitz C, Winkelmann R, Benz AH, Kraft R, Bechmann I, Dehghani F, Koch M. The GPR55 ligand l-α-lysophosphatidylinositol exerts microglia-dependent neuroprotection after excitotoxic lesion. Glia. 2013;61:1822–31.
Morozov YM, Dominguez MH, Varela L, Shanabrough M, Koch M, Horvath TL, Rakic P. Antibodies to cannabinoid type 1 receptor co-react with stomatin-like protein 2 in mouse brain mitochondria. Eur J Neurosci. 2013;38:2341–8.
Kallendrusch S, Hobusch C, Ehrlich A, Nowicki M, Ziebell S, Geisslinger G, Koch M, Dehghani F. Intrinsic up-regulation of 2-AG favors an area specific neuronal survival in different in vitro models of neuronal damage. PLoS One. 2012;7:e51208.
Koch M, Horvath TL. Reward aspects of gastrointestinal hormones mediated by brain g protein-coupled receptors. Biol Psych 2012;72:340-2.
Kallendrusch S, Hobusch C, Ehrlich A, Ziebell S, Ueda N, Geisslinger G, Koch M, Dehghani F. Site-specific and time-dependent activation of the endocannabinoid system after transection of long-range projections. PLoS One. 2012;7:e33537.
Grabiec U, Koch M, Kallendrusch S, Kraft R, Hill K, Merkwitz C, Ghadban C, Lutz B, Straiker A, Dehghani F. The endocannabinoid N-arachidonoyldopamine (NADA) exerts neuroprotective effects after excitotoxic neuronal damage via cannabinoid receptor 1 (CB(1)). Neuropharmacol. 2012;62:1797-807.
Koch M, Kreutz S, Böttger C, Grabiec U, Ghadban C, Korf HW, Deghani F. The cannabinoid WIN 55,212-2-mediated protection of dentate gyrus granule cells is driven by CB1 receptors and modulated by TRPA1 and Cav2.2 channels. Hippocampus. 2011;21:554-64.
Koch M, Kreutz S, Böttger C, Ghadban C, Korf HW, Dehghani F. Palmitoylethanolamide (PEA) protects dentate gyrus granule cells via peroxisome proliferator-activated receptor (PPAR)-alpha. Neurotoxicity Res. 2011;19:330-40.