A4 - Innervation von Fettgewebe: Identifikation von Akteuren und deren Funktionen
Die Projekt wurde von 2013 bis 2016 durch die Deutsche Forschungsgemeinschaft im Rahmen des SFB 1052 gefördert. Unter einer inhaltlichen Neuausrichtung wird es im SFB-Projekt B9 fortgesetzt.
Adipositas ist die krankhafte Vermehrung von Fettgewebe und zeigt eine steigende Prävalenz in den Industrienationen. Obwohl Adipositas mit einem erhöhten Risiko für Diabetes mellitus Typ 2, Hyperlipidämie, Bluthochdruck und verschiedene Arten von Krebs assoziert ist, bleibt unsere Kenntnis über die physiologische Entwicklung des Fettgewebes, als auch dessen Abbau stark eingeschränkt. Die nervale Innervation des Fettgewebes scheint einen großen Einfluss auf die Architektur dieses Gewebes auszuüben. Der zugrundeliegende Mechanismus ist bisher unbekannt. Mittels Lebend-Mikroskopie von Fettgewebspräparaten möchten wir die direkten Zielzellen der nervalen Innervation im Fettgewebe und funktionell wichtige Transmittersysteme identifizieren. Über diesen Ansatz sollen pharmakologische Ansätze herausgearbeitet werden, um sowohl die Funktion von Fettzellen, als auch die Rekrutierung von möglichen Fettzellvorläuferzellen zu beeinflussen.
Unsere Arbeitshypothese ist, dass die Innervation des Fettgewebes sowohl den Stoffwechsel reifer Fettzellen, als auch die Proliferation und Differenzierung von Vorläuferzellen kontrolliert.
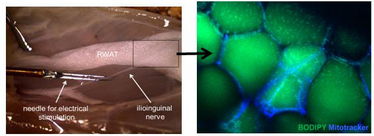
Abbildung 1: Simultane elektrische Stimulation von peripheren Nerven, die in das retroperitoneale Fettpolster (RWAT) verlaufen, und quantitative Mikroskopie werden Einblicke in die direkten Zielzellen der Fettgewebeinnervation und deren Funktion geben. Die Adipozyten sind sichtbar nach Lipid-(Bodipy)- und Mitochondrien-(Mitotracker)-Färbung.
Bechor S, Nachmias D, Elia N, Haim Y, Vatarescu M, Leikin-Frenkel A, Gericke M, Tarnovsky T, Las G, Rudich A. Adipose tissue conditioned media support macrophage lipid-droplet biogenesis by interfering with autophagic flux. Biochim Biophys Acta. 2017; Epub ahead of print.
Braune J, Weyer U, Matz-Soja M, Hobusch C, Kern M, Kunath A, Klöting N, Kralisch S, Blüher M, Gebhardt R, Zavros Y, Bechmann I, Gericke M. Hedgehog signaling in myeloid cells impacts on body weight, adipose tissue inflammation and glucose metabolism. Diabetologia. 2017;60:889-99.
Stelzner K, Herbert D, Popkova Y, Lorz A,Schiller J, Gericke M, Klöting N, Blüher M, Franz S, Simon JC, Saalbach A. Free fatty acids sensitize dendritic cells to amplify TH1/TH17-immune responses. Eur J Immunol. 2016;46:2043-53.
Orthgiess J, Gericke M, Immig K, Schulz A, Hirrlinger J, Bechmann I, Eilers J. Neurons exhibit Lyz2 promoter activity in vivo: Implications for using LysM-Cre mice in myeloid cell research. Eur J Immunol. 2016;46:1529-32.
du Plessis J, van Pelt J, Korf H, Mathieu C, van der Schueren B, Lannoo M, Oyen T, Topal B, Fetter G, Nayler S, van der Merwe T, Windmolders P, van Gaal L, Verrijken A, Hubens G, Gericke M, Cassiman D, Francque S, Nevens F, van der Merwe S. Association of adipose tissue inflammation with histological severity of non-alcoholic fatty liver disease. Gastroenterology. 2015;149:635-48.
Gericke M, Weyer U, Braune J, Bechmann I, Eilers J. A method for long-term live-imaging of tissue macrophages in adipose tissue explants. Am J Physiol Endocrinol Metab. 2015;308:E1023-33.
Kälin S, Heppner FL, Bechmann I, Prinz M, Tschöp MH, Yi CX. Hypothalamic innate immune reaction in obesity. Nat Rev Endocrinol. 2015;11:339-51.
Koch M, Varela L, Kim JG, Kim JD, Hernandez-Nuno F, Simonds SE, Castorena CM, Vianna CR, Elmquist JK, Morozov YM, Rakic P, Bechmann I, Cowley MA, Szigeti-Buck K, Dietrich MO, Gao XB, Diano S, Horvath TL. Hypothalamic POMC neurons promote cannabinoid-induced feeding. Nature. 2015;519:45-50.
Stenkamp-Strahm CM, Nyavor YE, Kappmeyer AJ, Horton S, Gericke M, Balemba OB. Prolonged high fat diet ingestion, obesity, and type 2 diabetes symptoms correlate with phenotypic plasticity in myenteric neurons and nerve damage in the mouse duodenum. Cell Tissue Res. 2015;361:411-26.
Berry R, Church CD, Gericke MT, Jeffery E, Colman L, Rodeheffer MS. Imaging of adipose tissue. Methods Enzymol. 2014;537:47-73.
Haase J, Weyer U, Immig K, Klöting N, Blüher M, Eilers J, Bechmann I, Gericke M. Local proliferation of macrophages in adipose tissue during obesity-induced inflammation. Diabetologia. 2014;57:562-71.
Kosacka J, Nowicki M, Blüher M, Baum P, Stockinger M, Toyka KV, Klöting I, Stumvoll M, Serke H, Bechmann I, Klöting N. Increased autophagy in peripheral nerves may protect Wistar Ottawa Karlsburg W rats against neuropathy. Exp Neurol. 2013;250:125-35.
Gericke MT, Schröder T, Kosacka J, Nowicki M, Klöting N, Spanel-Borowski K. Neuropeptide Y impairs insulin-stimulated translocation of glucose transporter 4 in 3T3-L1 adipocytes through Y1 receptor. Mol Cell Endocrinol. 2012;348:27-32.
Prodinger C, Bunse J, Krüger M, Schiefenhövel F, Brandt C, Laman JD, Greter M, Immig K, Heppner F, Becher B, Bechmann I. CD11c-expressing cells reside in the juxtavascular parenchyma and extend processes into the glia limitans of the mouse nervous system. Acta Neuropathol. 2011;121:445-58.
Hallermann S, Fejytova A, Schmidt H, Weyhersmüller A, Silver RA, Gundelfinger ED, Eilers J. Bassoon speeds vesicle reloading at a central excitatory synapse. Neuron. 2010;68:710-23.
Gericke MT, Kosacka J, Koch D, Nowicki M, Schröder T, Ricken AM, Nieber K, Spanel-Borowski K. Receptors for NPY and PACAP differ in expression and activity during adipogenesis in the murine 3T3-L1 fibroblast cell line. Br J Pharmacol. 2009;157:620-32.
Gao Q, Mezei G, Nie Y, Rao Y, Choi CS, Bechmann I, Leranth C, Toran-Allerand D, Priest CA, Roberts JL, Gao XB, Mobbs C, Shulman GI, Diano S, Horvath TL. Anorectic estrogen mimics leptin's effect on the rewiring of melanocortin cells and Stat3 signaling in obese animals. Nat Med. 2007;13:89-94.
Wilms CD, Schmidt H, Eilers J. Quantitative two-photon Ca2+ imaging via fluorescence lifetime analysis. Cell Calcium. 2006;50:73-9.
Bechmann I, Goldmann J, Kovac AD, Kwidzinski E, Simbürger E, Naftolin F, Dirnagl U, Nitsch R, Priller J. Circulating monocytic cells infiltrate layers of anterograde axonal degeneration whre they transform into microglia. FASEB J. 2005;19:647-9.
Priller J, Flügel A, Wehner T, Boentert M, Haas CA, Prinz M, Fernandez-Klett F, Prass K, Bechmann I, de Boer BA, Frotscher M, Kreutzberg GW, Persons DA, Dirnagl U. Targeting gene-modified hematopoietic cells to the central nervous system: use of green fluorescent protein uncovers microglial engraftment. Nat Med. 2001;7:1356-61.
Garaschuk O, Linn J, Eilers J, Konnerth A. Large-scale oscillatory calcium waves in the immature cortex. Nat Neurosci. 2000;3:452-9.
Takechi H, Eilers J, Konnerth A. A new class of synaptic response involving calcium release in dendritic spines. Nature. 1998;396:757-60.
PROJECT TEAM
| Prof. Dr. Jens Eilers Universität Leipzig Medizinische Fakultät Carl-Ludwig-Institut für Physiologie Liebigstraße 27 04103 Leipzig |
Prof. Dr. Ingo Bechmann Universität Leipzig Medizinische Fakultät Institut für Anatomie Liebigstraße 13 04103 Leipzig |