B11 - Identifizierung von kausalen Mechanismen für das individuelle Ansprechen auf Gewichts-reduzierende Ernährungsinterventionen
Projekt B11 vereint Expertisen aus klinischen und epidemiologischen Studien und Bioinformatik, um individuelle Kurz- und Langzeiteffekte von Ernährungsinterventionen wie zum Beispiel Gewichtsreduktion und Folgeerkrankungen der Adipositas auf molekularer Ebene zu untersuchen. Es wird das Ziel verfolgt, vorherzusagen, ob und warum ein Patient von Ernährungsinterventionen profitiert. Hierbei soll über rein assoziative Beziehungen hinausgegangen werden, indem umfangreiche kausale Ketten aus Ernährungsintervention, hierdurch hervorgerufenen Veränderungen auf molekularer Ebene, resultierender Gewichtsreduktion und schließlich langfristigen Folgeerkrankungen aufgebaut werden. Diese Kausalketten bieten Ansatzpunkte für neue Therapieüberwachungsprogramme und therapeutische Interventionen.
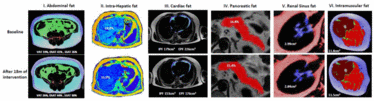
Abbildung 1: Dynamik der menschlichen Fettdepots/-ablagerungen während der 18monatigen Intervention. MRT-Abbildung der menschlichen Fettdepots/-ablagerungen zur Ausgangslage und nach der 18monatigen Intervention mit einem moderaten Gewichtsverlust (6%). (I) Bauchfett – Viszeralfett (grün), tiefes subkutanes Fett (hellblau), oberflächliches subkutanes Fett (blau), nicht-klassifiziertes Fett (rot), randmuskuläres Fett (violett); (II) intrahepatisches Fett; (III) kardiales Fett – vom intra-perikardialen Fett (IPF, hellblau) und eine ähnliche Reduktion des extra-perikardialen Fetts (EPF, violett, n = 80 für die kardiologische Unterstudie); (IV) Pankreasfett (rot); (V) Renal-Sinus-Fett (blau); (VI) Femur-intramuskuläres Fett (grün).
Yaskolka Meir A, Tuohy K, von Bergen M, Krajmalnik-Brown R, Heinig U, Zelicha H, Tsaban G, Rinott E, Kaplan A, Aharoni A, Zeibich L, Chang D, Dirks B, Diotallevi C, Arapitsas P, Vrhovsek U, Ceglarek U, Haange SB, Rolle-Kampczyk U, Engelmann B, Lapidot M, Colt M, Sun Q, Shai I. The Metabolomic-Gut-Clinical Axis of Mankai Plant-Derived Dietary Polyphenols. Nutrients. 2021 May 30;13(6):1866.
Yaskolka Meir A, Keller M, Müller L, Bernhart SH, Tsaban G, Zelicha H, Rinott E, Kaplan A, Gepner Y, Shelef I, Schwarzfuchs D, Ceglarek U, Stadler P, Blüher M, Stumvoll M, Kovacs P, Shai I. Effects of lifestyle interventions on epigenetic signatures of liver fat: CENTRAL randomized controlled trial. Liver Int. 2021 May 3.
Rinott E, Youngster I, Meir AY, Tsaban G, Kaplan A, Zelicha H, Rubin E, Koren O, Shai I. Autologous fecal microbiota transplantation can retain the metabolic achievements of dietary interventions. Eur J Intern Med. 2021 Apr 18:S0953-6205(21)00110-2.
Meir A Y, Keller Maria, Bernhart S H, Rinott E, Tsaban G, Zelicha H, Kaplan A, Schwarzfuchs D, Shelef I, Gepner Y, Li J, Lin Y, Blüher M, Ceglarek U, Stumvoll M, Stadler P F, Stampfer M J, Kovacs P, Liang L, Shai I. Lifestyle weight‑loss intervention may attenuate methylation aging: the CENTRAL MRI randomized controlled trial. Clin Epigenetics. 2021 Mar 4;13(1):48.
Yaskolka Meir A, Rinott E, Tsaban G, Zelicha H, Kaplan A, Rosen P, Shelef I, Youngster I, Shalev A, Blüher M, Ceglarek U, Stumvoll M, Tuohy K, Diotallevi C, Vrhovsek U, Hu F, Stampfer M, Shai I. Effect of green-Mediterranean diet on intrahepatic fat: the DIRECT PLUS randomised controlled trial. Gut. 2021 Jan 18:gutjnl-2020-323106.
Rinott E,Youngster I, Meir AY, Tsaban G, Zelicha H, Kaplan A, Knights D,Tuohy K, Fava F, Scholz MU, Ziv O, Reuven E, Tirosh A, Rudich A, Blüher M, Stumvoll M, Ceglarek U, Clement K, Koren O, Wang DD, Hu FB, Stampfer MJ, Shai I. Effects of Diet-Modulated Autologous Fecal Microbiota Transplantation on Weight Regain. Gastroenterology. 2021 Jan;160(1):158-173.e10.
Keller M, Yaskolka Meir A, Bernhart SH, Gepner Y, Shelef I, Schwarzfuchs D, Tsaban G, Zelicha H, Hopp L, Müller L, Rohde K, Böttcher Y, Stadler PF, Stumvoll M, Blüher M, Kovacs P, Shai I. DNA methylation signature in blood mirrors successful weight-loss during lifestyle interventions: the CENTRAL trial. Genome Med. 2020 Nov 16;12(1):97.
Sela I, Yaskolka Meir A, Brandis A, Krajmalnik-Brown R, Zeibich L, Chang D, Dirks B, Tsaban G, Kaplan A, Rinott E, Zelicha H, Arinos S, Ceglarek U, Isermann B, Lapidot M, Green R, Shai I. Wolffia globosa-Mankai Plant-Based Protein Contains Bioactive Vitamin B 12 and Is Well Absorbed in Humans. Nutrients . 2020 Oct 8;12(10):3067.
Levakov G, Kaplan A, Yaskolka Meir A, Rinott E, Tsaban G, Zelicha H, Meiran N, Shelef I, Shai I, Avidan G. Neural correlates of future weight loss reveal a possible role for brain-gastric interactions. Neuroimage. 2020 Sep 23;224:117403.
Zelicha H, Kaplan A, Yaskolka Meir A, Tsaban G, Rinott E, Shelef I, Tirosh A, Brikner D, Pupkin E, Qi L, Thiery J, Stumvoll M, Kloting N, von Bergen M, Ceglarek U, Blüher M, Stampfer MJ, Shai I. The Effect of Wolffia globosa Mankai, a Green Aquatic Plant, on Postprandial Glycemic Response: A Randomized Crossover Controlled Trial. Diabetes Care. 2019 Jul;42(7):1162-1169
Gepner Y, Shelef I, Komy O, Cohen N, Schwarzfuchs D, Bril N, Rein M, Serfaty D, Kenigsbuch S, Zelicha H, Yaskolka Meir A, Tene L, Bilitzky A, Tsaban G, Chassidim Y, Sarusy B, Ceglarek U, Thiery J, Stumvoll M, Blüher M, Stampfer MJ, Rudich A, Shai I. The beneficial effects of Mediterranean diet over low-fat diet may be mediated by decreasing hepatic fat Content. EBioMedicine. 2019 May 29. pii: S2352-3964(19)30358-5.
Yaskolka Meir A, Tsaban G, Zelicha H, Rinott E, Kaplan A, Youngster I, Rudich A, Shelef I, Tirosh A, Brikner D, Pupkin E, Sarusi B, Blüher M, Stümvoll M, Thiery J, Ceglarek U, Stampfer MJ, Shai I. A Green-Mediterranean Diet, Supplemented with Mankai Duckweed, Preserves Iron-Homeostasis in Humans and Is Efficient in Reversal of Anemia in Rats. J Nutr. 2019 Mar 27. pii: nxy321.
Kaplan A, Zelicha H, Tsaban G, Yaskolka Meir A, Rinott E, Kovsan J, Novack L, Thiery J, Ceglarek U, Burkhardt R, Willenberg A, Tirosh A, Cabantchik I, Stampfer MJ, Shai I. Protein bioavailability of Wolffia globosa duckweed, a novel aquatic plant, - A randomized controlled trial. Clin Nutr. 2018 Dec 11. pii: S0261-5614(18)32577-9.
Tene L, Shelef I, Schwarzfuchs D, Gepner Y, Yaskolka Meir A, Tsaban G, Zelicha H, Bilitzky A, Komy O, Cohen N, Bril N, Rein M, Serfaty D, Kenigsbuch S, Chassidim Y, Sarusy B, Ceglarek U, Stumvoll M, Blüher M, Thiery J, Stampfer MJ, Rudich A, Shai I. The effect of long-term weight-loss intervention strategies on the dynamics of pancreatic-fat and morphology: An MRI RCT study.Clin Nutr ESPEN. 2018 Apr;24:82-89.
Gepner Y, Shelef I, Schwarzfuchs D, Cohen N, Bril N, Rein M, Tsaban G, Zelicha H, Yaskolka Meir A, Tene L, Sarusy B, Rosen P, Hoffman JR, Stout JR, Thiery J, Ceglarek U, Stumvoll M, Blüher M, Stampfer MJ, Shai I. Intramyocellular triacylglycerol accumulation across weight loss strategies; Sub-study of the CENTRAL trial. PLoS One. 2017;12:e0188431.
Gepner Y, Shelef I, Schwarzfuchs D, Zelicha H, Tene L, Yaskolka Meir A, Tsaban G, Cohen N, Bril N, Rein M, Serfaty D, Kenigsbuch S, Komy O, Wolak A, Chassidim Y, Golan R, Avni-Hassid H, Bilitzky A, Sarusi B, Goshen E, Shemesh E, Henkin Y, Stumvoll M, Blüher M, Thiery J, Ceglarek U, Rudich A, Stampfer MJ, Shai I. Effect of distinct lifestyle interventions on mobilization of fast storage pools: the CENTRAL MRI randomized control trial. Circulation. 2017; Epub ahead of print.
Tsaban G, Wolak A, Avni-Hassid H, Gepner Y, Shelef I, Henkin Y, Schwarzfuchs D, Cohen N, Bril N, Rein M, Serfaty D, Kenigsbuch S, Tene L, Zelicha H, Yaskolka-Meir A, Komy O, Bilitzky A, Chassidim Y, Ceglarek U, Stumvoll M, Blüher M, Thiery J, Dicker D, Rudich A, Stamper MJ, Shai I. Dynamics of intrapericardial and extrapericardial fat tissues during long-term, dietary-induced, moderate weight loss. Am J Clin Nutr. 2017;106:984-95.
Meir AY, Tene L, Cohen N, Shelef I, Schwarzfuchs D, Gepner Y, Zelicha H, Rein M, Bril N, Serfaty D, Kenigsbuch S, Chassidim Y, Sarusy B, Dicker D, Thiery J, Ceglarek U, Stumvoll M, Blüher M, Stampfer MJ, Rudich A, Shai I. Intrahepatic fat, abdominal adipose tissues, and metabolic state; magnetic resonance imaging study. Diabetes Metab Res Rev. 2017; Epub ahead of print.
Gepner Y, Golan R, Harman-Boehm I, Henkin Y, Schwarzfuchs D, Shelef I, Durst R, Leitersdorf E, Spitzen S, Blag S, Shemesh E, Witkow S, Tangi-Rosental O, Chassidim Y, Liberty I, Sarusi B, Ben-Avraham S, Kovsan J, Bolotin A, Helander A, Ceglarek U, Stumvoll M, Blüher M, Thiery J, Rudich A, Stampfer MJ, Shai I. Effects of Initiating Moderate Alcohol Intake on Cardiometabolic Risk in Adults With Type 2 Diabetes: A 2-Year Randomized, Controlled Trial. Ann Intern Med. 2015;163:569-79.
Gepner Y, Bril N, Shelef I, Schwarzfuchs D, Serfaty D, Rein M, Cohen N, Shemesh E, Tangi-Rosental O, Sarusi B, Goshen E, Kenigsbuch S, Chassidim Y, Golan R, Witkow S, Henkin Y, Stampfer MJ, Rudich A, Shai I. Higher visceral adiposity is associated with an enhanced early thermogenic response to carbohydrate-rich food. Clin Nutr. 2015;35:422-7.
Golan R, Shelef I, Rudich A, Gepner Y, Shemesh E, Chassidim Y, Harman-Boehm I, Henkin Y, Schwarzfuchs D, Ben Avraham S, Witkow S, Tangi-Rosental O. Liberty I. Sarusi B. Stampfer MJ. Shai I. Abdominal superficial subcutaneous fat – a putative distinct protective fat sub-depot in type 2 diabetes. Diabetes Care. 2012;35:640-7.
Blüher M, Rudich A, Klöting N, Golan R, Henkin Y, Rubin E, Schwarzfuchs D, Gepner Y, Stampfer MJ, Fiedler M, Thiery J, Stumvoll M, Shai I. Two Patterns of Adipokine and Other Biomarker Dynamics in a Long-Term Weight Loss Intervention. Diabetes Care. 2012;35:342-9.
Erez G, Tirosh A, Rudich A, Meiner V, Schwarzfuchs D, Sharon D, Shpitzen S, Bluher M, Stumvoll M, Thiery M, Fiedler G, Friedlander Y, Leiterstdorf E, Shai I. Phenotypic and genetic variation in leptin as determinants of weight regain. Int J Obes. 2011;35:785-92.
Shai I, Spence DJ, Schwarzfuchs D, Henkin Y, Parraga G, Rudich A, Fenster A, Mallett C, Cohen NL, Tirosh A, Bolotin A, Thiery J, Fiedler GM, Blüher M, Stumvoll M, Stampfer MJ. Dietary intervention to reverse carotid atherosclerosis. Circulation. 2010;121:1200-8.
Schwarzfuchs D, Golan R, Shai I. Four-year follow-up after two-year dietary interventions. N Engl J Med. 2012;367:1373-4.
Tirosh A*, Shai I*, Afek A, Dubnov‑Raz G, Ayalon N, Gordon B, Derazne E, Tzur D, Shamis A, Vinker S, Rudich A. Adolescent Body Mass Index Trajectory and Risk of Diabetes versus Coronary Disease. N Engl J Med. 2011;364:1315-25.
Shai I, Schwarzfuchs D, Henkin Y, Shahar D, Witkow S, Greenberg I, Golan R, Fraser D, Bolotin A, Vardi H, Tangi O, Zuk R, Sarusi B, Brickner D, Schwartz Z, Sheiner E, Marko R, Katorza E, Thiery J, Fiedler M, Blüher M, Stumvoll M, Stampfer J. Weight Loss with Low-Carbohydrate, Mediterranean, or Low-Fat Diets. N Engl J Med. 2008;359:229-41.
Tirosh A *, Shai I*, Manova DT, Israeli E, Pereg D, Shochat T, Kochba I, Rudich A. Normal fasting plasma glucose levels and type 2 diabetes in young adult men. N Engl J Med. 2005;353:1454-62.
PostDoc
Janne Pott
Adresse: |
Institut für Medizinische Informatik, Statistik und Epidemiologie (IMISE)Härtelstraße 16-18
|
|
Telefon: E-Mail: |
0341 9716365 |


PostDoc
Andreas Kühnapfel
Adresse: |
Institut für Medizinische Informatik, Statistik und Epidemiologie (IMISE)Härtelstraße 16-18
|
|
Telefon: E-mail: |
0341 9716346 |