A8 - Verminderte Inflammationsreaktion und verbesserte Leptinsensitivität im Gehirn begünstigen nachhaltige Gewichtsreduktion im DIO Kleintiermodell
Gewichtszunahme wie auch diätetisches Versagen der Gewichtsreduktion gehen mit einer veränderten Zusammensetzung des intestinalen Mikrobioms wie auch einer veränderten Adipozytenmorphologie einher. Der Einfluss der bariatrischen Chirurgie auf Darmflora und Adipozyten wurde bisher noch kaum untersucht, insbesondere nicht deren funktioneller Einfluss auf die Energiehomöostase. Im Tiermodell haben wir in Vorarbeiten eine gesteigerte Thermoaktivität im braunen Fettgewebe nach RYGB Operation zeigen können. Im Folgenden möchten wir veränderte Signalwege zwischen Darm und Fettgewebe nach Bariatrischer Chirurgie im Tiermodell untersuchen sowie mechanistische Einflüsse auf verändertes Essverhalten postoperativ charakterisieren.
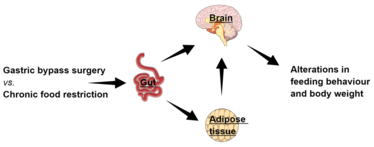
Abbildung 1: Magenbypass Chirurgie und chronische Kalorierestriktion modifizieren die Darm-Hirn und Darm-Adipozyten Interaktion auf unterschiedliche Weise, wodurch sich Essverhalten und Körpergewicht langfristig zwischen beiden Therapiestrategien unterscheiden.
Chen J, Haase N, Haange SB, Sucher R, Münzker J, Jäger E, Schischke K, Seyfried F, von Bergen M, Hankir MK, Krügel U, Fenske WK. Roux-en-Y gastric bypass contributes to weight loss-independent improvement in hypothalamic inflammation and leptin sensitivity through gut-microglia-neuron-crosstalk. Mol Metab. 2021 Mar 16:101214.
Hankir MK. A sympathetic gut connection drives the metabolic benefits of Roux-en-Y gastric bypass. Cell Stress. 2020 Nov 24;4(12):265-269.
Rullmann M, Preusser S, Poppitz S, Heba S, Gousias K, Hoyer J, Schütz T, Dietrich A, Müller K, Hankir MK, Pleger B., Adiposity Related Brain Plasticity Induced by Bariatric Surgery., Front Hum Neurosci. 2019 Aug 27;13:290.
Hankir MK, Rullmann M, Seyfried F, Preusser S, Poppitz S, Heba S, Gousias K, Hoyer J, Schütz T, Dietrich A, Müller K, Pleger B. Roux-en-Y gastric bypass surgery progressively alters radiologic measures of hypothalamic inflammation in obese patients. JCI Insight. 2019 Aug 29. pii: 131329.
Seyfried F, Hankir MK. Could de-stressing the brain be the solution for long-term weight loss? Cell Stress. 2019 Jan 25;3(2):29-37.
Hankir MH, Klingenspor M. Brown adipocyte glucose metabolism: a heated subject. EMBO Rep. 2018 Aug 22. pii: e46404.
Hankir MH, Seyfried F, Miras AD, Cowley MA. Brain Feeding Circuits after Roux-en-Y Gastric Bypass.Trends Endocrinol Metab. 2018 Feb 20: S1043-2760(18)30018-3.
Hankir M. Loading and firing the brown adipocyte. Adipocyte. 2017; Epub ahead of print.
Hankir MK, Kranz M, Gnad T, Weiner J, Wagner S, Deuther-Conrad W, Bronisch F, Steinhoff K, Luthardt J, Klöting N, Hesse S, Seibyl J, Sabri O, Heiker J, Blüher M, Pfeifer A, Brust P, Fenske WK. EMBO Mol Med. 2016;8:796-812.
Hankir MK, Bronisch F, Hintschich C, Krügel U, Seyfried F, Fenske WK. Differential effects of Roux-en-Y gastric bypass surgery on brown and beige adipose tissue thermogenesis. Metabolism. 2015;64:1240-9.
Wu Q, Li JV, Seyfried F, le Roux CW, Ashrafian H, Athanasiou T, Fenske W, Darzi A, Nicholson JK, Holmes E, Gooderham NJ.Metabolic phenotype-microRNA data fusion analysis of the systemic consequences of Roux-en-Y gastric bypass surgery. Int J Obes (Lond). 2015; 39:1126-34.
Smith MA, Katsouri L, Irvine EE, Hankir MK, Pedroni SM, Voshol PJ, Gordon MW, Choudhury AI, Woods A, Vidal-Puig A, Carling D, Withers DJ. Deletion of S6K1 in POMC neurons impairs peripheral lipid homeostasis and leptin sensitivity in mice. Cell Rep. 2015;11:335-43.
Frost G, Sleeth ML, Arisoylu-Sahuri M, Lizarbe B, Cerdan S, Brody L, Anastasovska J, Ghourab S, Hankir M, Zhang S, Carling D, Swan J, Gibson G, Viardot A, Thomas L, Bell JD. Nat Comm. 2014;5:3611.
Seyfried F, Li JV, Miras AD, Fenske WK, Cluny NL, Lannoo M, Sharkey KA, Nicholson JK, le Roux CW, Holmes E. Urinary phenotyping indicates weight loss-independent metabolic effects of Roux-en-Y gastric bypass in mice. J Proteome Res. 2013;12:1245-53.
Seyfried F, Miras AD, Fenske W, Bueter M, Prechtl CG, Spector AC, le Roux CW. Effects of preoperative exposure to a high-fat versus a low-fat diet on ingestive behavior after gastric bypass surgery in rats. Surg Endosc. 2013;27:4192-201.
Fenske WK, Dubb S, Bueter M, Seyfried F, Patel K, Tam FW, Frankel AH, le Roux CW. Effect of bariatric surgery-induced weight loss on renal and systemic inflammation and blood pressure: a 12-month prospective study. Surg Obes Relat Dis. 2013;9:559-68.
Fenske WK, Bueter M, Miras AD, Ghatei MA, Bloom SR, le Roux CW. Exogenous peptide YY3-36 and Exendin-4 further decrease food intake, whereas octreotide increases food intake in rats after Roux-en-Y gastric bypass. Int J Obes (Lond). 2012;36:379-84.
Hankir M, Parkinson J, Minnion M, Addison M, Bloom SR, Bell JD. PYY3-36 and Pancreatic Polypeptide differentially regulate hypothalamic neuronal activity in mice in vivo as shown by Manganese Enhanced MRI. J Neuroendocrinol. 2011;23:371-80.