C4 - Strukturelle Untersuchungen an Adipokinen und anderen Adipositas-assoziierten Proteinen
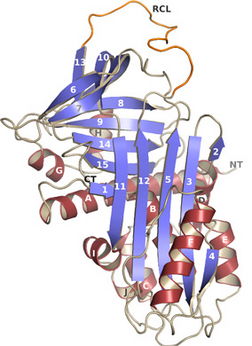
Wir untersuchen die Raunstrukturen und den molekularen Funktionsmechanismus von Proteinen, die für Adipositas relevant sind. In bisherigen Arbeiten haben wir die strukturelle Basis des Mechanismus der Inhibition von Kallikrein 7 (Klk7) durch den Serinprotease-Inhibitor Vaspin analysiert. Weitere Arbeiten dieses Unterprojektes fokussieren auf die Interaktion mit Heparin, welches die Inhibitorwirkung von Vaspin gegenüber Klk7 verstärkt. Weiterhin untersuchen wir die Vaspin-Klk7-Interaktion durch die Bestimmung einer Kristallstruktur des Protein-Protein-Komplexes und durch Strukturen mit gebundenen Peptiden. Durch eine Mutationsanalyse von postulierten Exosites (sekundäre Interaktionsstellen abseits der Bindung der reaktiven Schlaufe) wird die Bedeutung einzelnen Reste zur inhibitorische Interaktionen näher charakterisiert.
Frenster JD, Stephan G, Ravn-Boess N, Bready D, Wilcox J, Kieslich B, Wilde C, Sträter N, Wiggin GR, Liebscher I, Schöneberg T, Placantonakis DG. Functional impact of intramolecular cleavage and dissociation of adhesion G protein-coupled receptor GPR133 (ADGRD1) on canonical signaling. J Biol Chem. 2021 May 19:100798.
Hanke S, Tindall CA, Pippel J, Ulbricht D, Pirotte B, Reboud-Ravaux M, Heiker JT, Sträter N. Structural Studies on the Inhibitory Binding Mode of Aromatic Coumarinic Esters to Human Kallikrein-Related Peptidase 7. J Med Chem. 2020 Jun 11;63(11):5723-5733.
Tindall CA, Dommel S, Riedl V, Ulbricht D, Hanke S, Sträter N, Heiker JT. Membrane Phospholipids and Polyphosphates as Cofactors and Binding Molecules of SERPINA12 (vaspin). Molecules. 2020 Apr 24;25(8):1992.
Bhattarai S, Pippel J, Scaletti E, Idris R, Freundlieb M, Rolshoven G, Renn C, Lee SY, Abdelrahman A, Zimmermann H, El-Tayeb A, Müller CE, Sträter N. 2-Substituted α,β-Methylene-ADP Derivatives: Potent Competitive Ecto-5'-nucleotidase (CD73) Inhibitors with Variable Binding Modes. J Med Chem. 2020 Feb 28.
Ulbricht D, Tindall CA, Oertwig K, Hanke S, Sträter N, Heiker JT. Kallikrein-related peptidase 14 is the second KLK protease targeted by the serpin vaspin. Biological Chemistry 2018 Feb 1.
Oertwig K, Ulbricht D, Hanke S, Pippel J, Bellmann-Sickert K, Sträter N, Heiker JT. Glycosylation of human vaspin (SERPINA12) and its impact on serpin activity, heparin binding and thermal stability. Biochim Biophys Acta. 2017;1865:1100-3.
Ulbricht D, Oertwig K, Arnsburg K, Saalbach A, Pippel J, Sträter N, Heiker JT. Basic Residues of β-Sheet A Contribute to Heparin Binding and Activation of Vaspin (Serpin A12). J Biol Chem. 2017;292:994-1004.
Pippel J, Küttner EB, Ulricht D, Daberger J, Schultz S, Heiker JT, Sträter N. Crystal structure of cleaved vaspin (serpinA12). Biol Chem. 2016;397:111-23.
Ulbricht D, Pippel J, Schultz S, Meier R, Sträter N, Heiker JT. A unique serpin P1' glutamate and a conserved beta-sheet C arginine are key residues for activity, protease recognition and stability of serpinA12 (vaspin). Biochem J. 2015;470:357-67.
Heiker JT, Klöting N, Kovacs P, Kuettner EB, Sträter N, Schultz S, Kern M, Stumvoll M, Blüher M, Beck-Sickinger AG. Vaspin inhibits kallikrein 7 by serpin mechanism. Cell Mol Life Sci. 2013;70:2569-83.