B2 - Die Rolle von miRNAs in einzelnen Zellen des menschlichen Fettgewebes im Rahmen des E2F1-, Entzündungs- und Autophagie-Netzwerks
Autophagie spielt eine Rolle bei der Entstehung der Fehlfunktion des Fettgewebes. Bei humaner Adipositas steht die aktivierte Autophagie im Fettgewebe auch unter der Kontrolle des Faktors E2F1 und von spezifischen miRNAs. Deshalb soll in diesem Projekt untersucht werden, wie E2F1 zu erhöhter Autophagie des Fettgewebes bei Adipositas beiträgt und welche miRNAs diese E2F1-abhängigen Prozesse regulieren. Dazu sollen die Interaktionen des E2F1-Autophagy-Inflammation-Netzwerks in der Einzelzell-Auflösung und in Relation zu zirkulierenden miRNA-Spiegeln charakterisiert werden. Mittels single-nucleus RNA-sequencing (sNucSeq), sollen Adipozyten-Subtypen der Fettgewebefehlfunktion hinsichtlich des Beitrags einzelner Zellpopulationen an der Entstehung der E2F1-vermittelten Fehlfunktion des Fettgewebes und deren kardiometabolischen Folgen identifiziert werden.
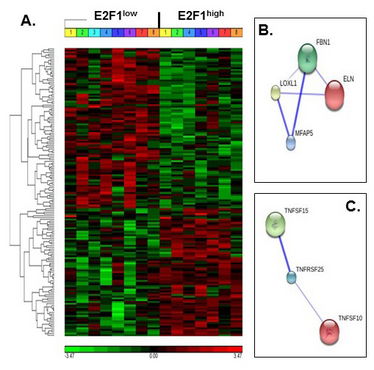
Abbildung 1: Erhöhte humane Fettgewebs-E2F1-Expression und E2F1-mRNA-Stabilität. A. Hierarchische Clusterbildung von unterschiedlich stark exprimierten Genen. Es wird ein unterschiedliches Transkriptom zwischen E2F1hoch und E2F1niedrig gezeigt, geteilt in Cluster von hochregulierten und herunterregulierten Genen. B und C. Ausgewählte Signalweg-Analysen, unter Verwendung der STRING10©Protein-Interaktions-Datenbank. Gezeigt werden prognostizierte und/oder experimentell nachgewiesene Signalwege von ECM-relevanten Genen und TNF-bezogenen Superfamilien-Genen, unterschiedlich stark exprimiert in unserer Kohorte. Die Linienstärke gibt das Konfidenzniveau der Interaktion wider.
Landgraf K, Klöting N, Gericke M, Maixner N, Guiu-Jurado E, Scholz M, Witte AV, Beyer F, Schwartze JT, Lacher M, Villringer A, Kovacs P, Rudich A, Blüher M, Kiess W, Körner A.The Obesity-Susceptibility Gene TMEM18 Promotes Adipogenesis through Activation of PPARG.Cell Rep. 2020 Oct 20;33(3):108295.
Mattar P, Sanhueza S, Yuri G, Briones L, Perez-Leighton C, Rudich A, Lavandero S, Cifuentes M. Calcium-Sensing Receptor in Adipose Tissue: Possible Association with Obesity-Related Elevated Autophagy. Int J Mol Sci. 2020 Oct 15;21(20):7617.
Zacharia A, Saidemberg D, Mannully CT, Kogan NM, Shehadeh A, Sinai R, Zucker A, Bruck-Haimson R, Goldstein N, Haim Y, Dani C, Rudich A, Moussaieff A. Distinct infrastructure of lipid networks in visceral and subcutaneous adipose tissues in overweight humans. Am J Clin Nutr. 2020 Aug 7;nqaa195.
Maixner N, Pecht T, Haim Y, Chalifa-Caspi V, Goldstein N, Tarnovscki T, Liberty IF, Kirshtein B, Golan R, Berner O, Monsonego A, Bashan N, Blüher M, Rudich A. A TRAIL-TL1A Paracrine Network Involving Adipocytes, Macrophages and lymphocytes Induces Adipose Tissue Dysfunction Downstream of E2F1 in Human Obesity. Diabetes. 2020 Jul 30;db191231.
Goldstein N, Kezerle Y, Gepner Y, Haim Y, Pecht T, Gazit R, Polischuk V, Liberty IF, Kirshtein B, Shaco-Levy R, Blüher M, Rudich A. Higher Mast Cell Accumulation in Human Adipose Tissues Defines Clinically Favorable Obesity Sub-Phenotypes. Cells . 2020 Jun 20;9(6):E1508.
Hadadi-Bechor S, Haim Y, Pecht T, Gat R, Tarnovsky T, Gericke M, Rudich A, Autophagy differentially regulates macrophage lipid handling depending on the lipid substrate (oleic acid vs. acetylated-LDL) and inflammatory activation state., Biochim Biophys Acta Mol Cell Biol Lipids. 2019 Sep 11:158527
Heinitz S, Gebhardt C, Piaggi P, Krüger J, Heyne H, Weiner J, Heiker JT, Stumvoll M, Blüher M, Baier L, Rudich A, Kovacs P, Tönjes A. Atg7-knockdown reduces chemerin secretion in murine adipocytes. J Clin Endocrinol Metab. 2019 Jun 21. pii: jc.2018-01980.
Gepner Y, Shelef I, Komy O, Cohen N, Schwarzfuchs D, Bril N, Rein M, Serfaty D, Kenigsbuch S, Zelicha H, Yaskolka Meir A, Tene L, Bilitzky A, Tsaban G, Chassidim Y, Sarusy B, Ceglarek U, Thiery J, Stumvoll M, Blüher M, Stampfer MJ, Rudich A, Shai I. The beneficial effects of Mediterranean diet over low-fat diet may be mediated by decreasing hepatic fat Content. EBioMedicine. 2019 May 29. pii: S2352-3964(19)30358-5.
Goldstein N, Haim Y, Mattar P, Hadadi-Bechor S, Maixner N, Kovacs P, Blüher M, Rudich A. Leptin stimulates autophagy/lysosome-related degradation of long-lived proteins in adipocytes. Adipocyte. 2019 Jan 24.
Boura-Halfon S, Pecht T, Jung S, Rudich A. Obesity and dysregulated central and peripheral Macrophage-neuron crosstalk. Eur J Immunol. 2018 Nov 8.
Haim Y, Blüher M, Konrad D, Goldstein N, Klöting N, Harman-Boehm I, Kirshtein B, Ginsberg D, Tarnovscki T, Gepner Y, Shai I, Rudich A. ASK1 (MAP3K5) is transcriptionally upregulated by E2F1 in adipose tisue in obesity, molecularly defining a human dys-metabolic obese phenotype. Mol Metab. 2017;6:725-36.
Bechor S, Nachmias D, Elia N, Haim Y, Vatarescu M, Leikin-Frenkel A, Gericke M, Tarnovsky T, Las G, Rudich A. Adipose tissue conditioned media support macrophage lipid-droplet biogenesis by interfering with autophagic flux. Biochim Biophys Acta. 2017;1862:1001-12.
Pecht T, Haim Y, Bashan N, Shapiro H, Harman-Boehm I, Kirshtein B, Clement K, Shai I, Rudich A. Circulating blood monocyte subclasses and lipid-laden adipose tissue macrophages in human obesity. PLoS One. 2016;11:e0159350.
Slutsky N, Vatarescu M, Haim Y, Goldstein N, Kirshtein B, Harman-Boehm I, Gepner Y, Shai I, Bashan N, Blüher M, Rudich A. Decreased adiponectin links elevated adipose tissue autophagy with adipocyte endocrine dysfunction in obesity. Int J Obes (Lond). 2016;40:912-20.
Haim Y, Blüher M, Slutsky N, Goldstein N, Klöting N, Harman-Boehm I, Kirshstein B, Ginsberg D, Gericke M, Guiu Jurado E, Kovsan J, Tarnovscki T, Kachko L, Bashan N, Gepner Y, Shai I, Rudich A. Elevated autophagy gene expression in adipose tissue of humans: A potential non-cell-cycle-dependent function of E2F1. Autophagy. 2015;11:2074-88.
Stienstra R, Haim Y, Riahi Y, Netea M, Rudich A, Leibowitz G. Autophagy in adipose tissue and the beta cell: implications for obesity and diabetes. Diabetologia. 2014;57:1505-16.
Haim Y, Tarnovscki T, Bashari D, Rudich A. A chromatin immunoprecipitation (ChIP) protocol for use in whole human adipose tissue. Am J Physiol Endocrinol Metab. 2013;305:E1172-7.
Pecht T, Gutman-Tirosh A, Bashan N, Rudich A. Periperal blood leucocyte subclasses as potential biomarkers of adipose tissue inflammation and obesity subphenotypes in humans. Obes Rev. 2014;15:322-37.
Rudich A, Klip A. Putting Rac1 on the path to glucose uptake. Diabetes. 2013;62:1831-2.
Tirosh A, Golan R, Harman-Boehm I, Henkin Y, Schwarzfuchs D, Rudich A, Kovsan J, Fiedler G, Blüher M, Stumvoll M, Thiery J, Stampfer M, Shai I. Renal function following three distinct weight loss dietary strategies during 2 years of randomized controlled trial. Diabetes Care. 2013;36:2225-32.
Wolak T, Sion-Vardi N, Novack V, Greenberg G, Szendro G, Tarnovscki T, Nov O, Shelef I, Paran E, Rudich A. N-terminal osteopontin, rather than full-length protein or C-terminal fragment, associates with carotid plaque inflammation in hypertensive patients. Am J Hypertension. 2013;26:326-33.
Nov O, Shapiro H, Ovadia H, Tarnovscki T, Dvir I, Shemesh E, Kovsan J, Shelef I, Carmi Y, Voronov E, Apte RN, Lewis E, Haim Y, Konrad D, Bashan N, Rudich A. Role of IL-1β in adipose tissue inflammation, expandability, and fat–liver crosstalk in obesity. PLoS One. 2013;8:e53626.
Shapiro H, Pecht T, Shaco-Levy R, Harman-Boehm I, Kirshtein B, Kuperman Y, Chen A, Blüher M, Shai I, Rudich A. Adipose tissue foam cells are present in human obesity. J Clin Endocrinol Metab. 2013;98:1173-81.
Golan R, Shelef I, Rudich A, Gepner Y, Shemesh E, Chassidim Y, Harman-Boehm I, Henkin Y, Schwarzfuchs D, Ben Avraham S, Witkow S, Tangi-Rosental O, Liberty IF, Sarusi B, Stampfer MJ, Shai I. Abdominal superficial subcutaneous fat – a putative distinct protective fat sub-depot in type 2 diabetes. Diabetes Care. 2012;35:640-7.
Blüher M, Rudich A, Klöting N, Golan R,Henkin Y, Rubin E, Schwarzfuchs D, Gepner Y, Stampfer M, Fiedler M, Thiery J, Stumvoll M, Shai I. Two patterns of adipokine and other biomarker dynamics in a long term weight loss intervention. Diabetes Care. 2012;35:342-9.
Klionsky DJ, Abdalla FC, Abeliovich H, [...], Rudich A, [...], Zuckerbraun B. Guidelines for the use and interpretation of assays for monitoring autophagy. Autophagy. 2012;8:445-544.
Maixner N, Kovsan J, Harman-Boehm I, Blüher M, Bashan N, Rudich A. Adipose tissue autophagy. Obesity Facts. 2012;5:710-21.
Kovsan J, Bluher M, Tarnovscki T, Kloting N, Kirshtein B, Madar L, Shai I, Golan R, Harman-Boehm I, Schon MR, Greenberg AS, Elazar Z, Bashan N, Rudich A. Altered autophagy in human adipose tissues in obesity. J Clin Endocrinol Metab. 2011;96:E268-77.
Ovadia H, Haim Y, Nov O, Almog O, Kovsan J, Bashan N, Benhar M, Rudich A. Increased adipocytes S-nitrosylaion targets the anti-lipolytic action of insulin: relevance to adipose tissue dysfunction in obesity. J Biol Chem. 2011;286:30433-43.
Kovsan J, Bashan N, Greenberg AS, Rudich A. Potential role of autophagy in modulation of lipid metabolism. Am J Physiol (Endocrinol Metab). 2010;298:E1-E7.
Nov O, Kohl A, Lewis EC, Bashan N, Dvir I, Ben-Shlomo S, Fishman S, Wueest S, Konrad D, Rudich A. Interleukin-1β may mediate insulin resistance in liver-derived cells in response to adipocyte inflammation. Endocrinology. 2010;151:4247-56.
Bluher M, Bashan N, Shai I, Harman-Boehm I, Tarnovscki T, Avinaoch E, Stumvoll M, Dietrich A, Kloting N, Rudich A. Activated Ask1-MKK4-p38MAPK/JNK stress signaling pathway in human omental fat tissue may link macrophage infiltration to whole-body Insulin sensitivity. J Clin Endocrinol Metab. 2009;94:2507-15.
Harman-Boehm I, Bluher M, Redel H, Sion-Vardy N, Ovadia S, Avinoach E, Shai I, Kloting N, Stumvoll M, Bashan N, Rudich A. Macrophage infiltration into omental versus subcutaneous fat across different populations: effect of regional adiposity and the comorbidities of obesity.J Clin Endocrinol Metab. 2007;92:2240-7.
Bashan N, Dorfman K, Tarnovscki T, Harman-Boehm I, Liberty IF, Bluher M, Ovadia S, Maymon-Zilberstein T, Potashnik R, Stumvoll M, Avinoac h E,Rudich A. Mitogen-activated protein kinases, inhibitory-kappaB kinase, and insulin signaling in human omental versus subcutaneous adipose tissue in obesity. Endocrinology. 2007;148:2955-62.
Postdoc
Yulia Haim
|
Adresse (Büro):
|
|
|
Tel.: (Labor/ Büro):
E-mail:
|
|
|
Forschungsthema:
|
|
Doktorandin
Nataly Makarenkov
|
Adresse (Büro):
|
|
|
Telefon:
E-mail:
|
|
|
Thema des Promotionsprojektes:
|
|
Doktorand
Alon Zemer
|
Adresse (Büro):
|
|
|
Telefon:
E-mail:
|
|
|
Thema des Promotionsprojektes:
|
|