A9 -Adipositas-induzierte Aktivierung der Mikroglia – funktionelle Bedeutung des zentralen Sterol-Stoffwechsels
Phytosterole kommen exklusiv aus pflanzlicher Nahrung. In der vorherigen Förderphase konnten wir zeigen, dass die Phytosterol Akkumulation im Hirn unter Hochfett-Diät Bedingungen reversibel ist und dass die Phytosterol Konzentrationen in in vivo und in vitro Modellsystemen invers mit der Cox-2 und Mikroglia Aktivierung korrelieren. Deshalb soll in der nächsten Förderperiode untersucht werden, wie Phytosterole und Fettsäuren die Blut-Hirn-Schranke überwinden und ob Phytosterole die inflammatorische Aktivierung der Mikroglia verhindern können. Dazu werden etablierte in vitro Blut-Hirn-Schranken-Modelle genutzt. Die zelluläre inflammatorische Antwort soll im Fettgewebe und Hirn von etablierten Mausmodellen, humanen Mikroglia-Modellen und isolierten Lipidrafts untersucht werden.
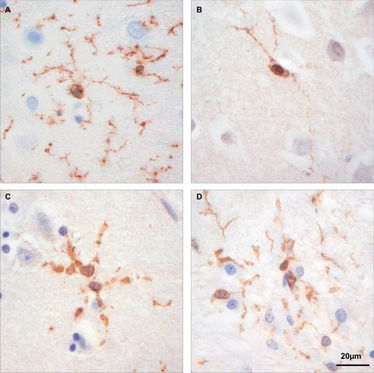
Abbildung 1. Morphologie der hippocampalen Mikroglia in verschiedenen Stadien der Alzheimer-Erkrankung [Braak&Braak I in (C) und Braak&Braak VI in (D)], im nicht-dementen gealterten (B) und im jungen Gehirn (A) nach Iba-1-Färbung. Entnommen aus Tischer et al. (Glia 2016).
Leyh J, Winter K, Reinicke M, Ceglarek U, Bechmann I, Landmann J. Long-term diet-induced obesity does not lead to learning and memory impairment in adult mice. PLoS One. 2021 Sep 29;16(9):e0257921.
Leyh J, Paeschke S, Mages B, Michalski D, Nowicki M, Bechmann I, Winter K. Classification of Microglial Morphological Phenotypes Using Machine Learning. Front Cell Neurosci. 2021 Jun 29;15:701673.
Yaskolka Meir A, Tuohy K, von Bergen M, Krajmalnik-Brown R, Heinig U, Zelicha H, Tsaban G, Rinott E, Kaplan A, Aharoni A, Zeibich L, Chang D, Dirks B, Diotallevi C, Arapitsas P, Vrhovsek U, Ceglarek U, Haange SB, Rolle-Kampczyk U, Engelmann B, Lapidot M, Colt M, Sun Q, Shai I. The Metabolomic-Gut-Clinical Axis of Mankai Plant-Derived Dietary Polyphenols. Nutrients. 2021 May 30;13(6):1866.
Yaskolka Meir A, Keller M, Müller L, Bernhart SH, Tsaban G, Zelicha H, Rinott E, Kaplan A, Gepner Y, Shelef I, Schwarzfuchs D, Ceglarek U, Stadler P, Blüher M, Stumvoll M, Kovacs P, Shai I. Effects of lifestyle interventions on epigenetic signatures of liver fat: CENTRAL randomized controlled trial. Liver Int. 2021 May 3.
Yaskolka Meir A, Keller M, Bernhart SH, Rinott E, Tsaban G, Zelicha H, Kaplan A, Schwarzfuchs D, Shelef I, Gepner Y, Li J, Lin Y, Blüher M, Ceglarek U, Stumvoll M, Stadler PF, Stampfer MJ, Kovacs P, Liang L, Shai I. Lifestyle weight-loss intervention may attenuate methylation aging: the CENTRAL MRI randomized controlled trial. Clin Epigenetics. 2021 Mar 4;13(1):48.
Yaskolka Meir A, Rinott E, Tsaban G, Zelicha H, Kaplan A, Rosen P, Shelef I, Youngster I, Shalev A, Blüher M, Ceglarek U, Stumvoll M, Tuohy K, Diotallevi C, Vrhovsek U, Hu F, Stampfer M, Shai I. Effect of green-Mediterranean diet on intrahepatic fat: the DIRECT PLUS randomised controlled trial. Gut. 2021 Jan 18:gutjnl-2020-323106.
Rinott E, Youngster I, Yaskolka Meir A, Tsaban G, Zelicha H, Kaplan A, Knights D, Tuohy K, Fava F, Scholz MU, Ziv O, Reuven E, Tirosh A, Rudich A, Blüher M, Stumvoll M, Ceglarek U, Clement K, Koren O, Wang DD, Hu FB, Stampfer MJ, Shai I. Effects of Diet-Modulated Autologous Fecal Microbiota Transplantation on Weight Regain. Gastroenterology. 2021 Jan;160(1):158-173.e10.
Kulow C, Reske A, Leimert M, Bechmann I, Winter K, Steinke H. Topography and evidence of a separate "fascia plate" for the femoral nerve inside the iliopsoas - A dorsal approach. J Anat. 2020 Dec 25.
Sela I, Yaskolka Meir A, Brandis A, Krajmalnik-Brown R, Zeibich L, Chang D, Dirks B, Tsaban G, Kaplan A, Rinott E, Zelicha H, Arinos S, Ceglarek U, Isermann B, Lapidot M, Green R, Shai I. Wolffia globosa-Mankai Plant-Based Protein Contains Bioactive Vitamin B 12 and Is Well Absorbed in Humans. Nutrients . 2020 Oct 8;12(10):3067.
Piotrowska A, Winter K, Carare RO, Bechmann I. Vital Functions Contribute to the Spread of Extracellular Fluids in the Brain: Comparison Between Life and Death. Front Aging Neurosci. 2020 Feb 11;12:15.
Beuchel C, Becker S, Dittrich J, Kirsten H, Toenjes A, Stumvoll M, Loeffler M, Thiele H, Beutner F, Thiery J, Ceglarek U, Scholz M., Clinical and lifestyle related factors influencing whole blood metabolite levels - A comparative analysis of three large cohorts. Mol Metab. 2019 Nov;29:76-85.
Zelicha H, Kaplan A, Yaskolka Meir A, Tsaban G, Rinott E, Shelef I, Tirosh A, Brikner D, Pupkin E, Qi L, Thiery J, Stumvoll M, Kloting N, von Bergen M, Ceglarek U, Blüher M, Stampfer MJ, Shai I. The Effect of Wolffia globosa Mankai, a Green Aquatic Plant, on Postprandial Glycemic Response: A Randomized Crossover Controlled Trial. Diabetes Care. 2019 Jul;42(7):1162-1169
García-Cáceres C, Balland E, Prevot V, Luquet S, Woods SC, Koch M, Horvath TL, Yi CX, Chowen JA, Verkhratsky A, Araque A, Bechmann I, Tschöp MH. Role of astrocytes, microglia, and tanycytes in brain control of systemic metabolism. Nat Neurosci. 2019 Jan;22(1):7-14.
Joost E, Jordão MJC, Mages B, Prinz M, Bechmann I, Krueger M. Microglia contribute to the glia limitans around arteries, capillaries and veins under physiological conditions, in a model of neuroinflammation and in human brain tissue. Brain Struct Funct. 2019 Jan 31.
Wagner R, Dittrich J, Thiery J, Ceglarek U, Burkhardt R. Simultaneous LC-MS/MS quantification of eight apolipoproteins in normal and hypercholesterolemic mouse plasma. J Lipid Res. 2019 Feb 5. pii: jlr.D084301
Dittrich J, Beutner F, Teren A, Thiery J, Burkhardt R, Scholz M, Ceglarek U. Plasma levels of apolipoproteins C-III, A-IV, and E are independently associated with stable atherosclerotic cardiovascular disease. Atherosclerosis. 2018 Nov 9;281:17-24.
Reinicke M, Schröter J, lMüller-Klieser D,Helmschrodt C, Ceglarek U. Free oxysterols and bile acids including conjugates - Simultaneous quantification in human plasma and cerebrospinal fluid by liquid chromatography-tandem mass spectrometry. Analytica Chimica Acta, march 2018
Kälin S, Heppner FL, Bechmann I, Prinz M, Tschöp MH, Yi CX. Hypothalamic innate immune reaction in obesity. Nat Rev Endocrinol. 2015;11:339-51.
Koch M, Varela L, Kim JG, Kim JD, Hernandez-Nuno F, Simonds SE, Castorena CM, Vianna CR, Elmquist JK, Morozov YM, Rakic P, Bechmann I, Cowley MA, Szigeti-Buch K, Dietrich MO, Gao XB, Diano S, Horvath TL. Hypothalamic POMC neurons promote cannabinoid-induced feeding. Nature. 2015;519:45-50.
Yi CX, Gericke M, Krüger M, Alkemade A, Kabra DG, Hanske S, Filosa J, Pfluger P, Bingham N, Woods SC, Herman J, Kalsbeek A, Baumann M, Lang R, Stern JE, Bechmann I, Tschöp MH. High calorie diet triggers hypothalamic angiopathy. Mol Metab. 2012;1:95-100.
Burkhardt R, Kirsten H, Beutner F, Holdt M, Gross A, Teren A, Tönjes A, Becker S, Krohn K, Kovacs P, Stumvoll M, Teupser D, Thiery J, Ceglarek U, Scholz M. Integration of genome-wide SNP data and gene-expression profiles reveals six novel loci and regulatory mechanisms for amino acids and acylcarnitines in whole blood. PLoS Genet. 2015;11:e1005510.
Helmschrodt C, Becker S, Thiery J, Ceglarek U. Preanalytical standardization for reactive oxygen species derived oxysterol analysis in human plasma by liquid chromatography-tandem mass spectrometry. Biochem Biophys Res Commun. 2014;446:726-30.
Kortz L, Dorow J, Ceglarek U. Liquid chromatography-tandem mass spectrometry for the analysis of eicosanoids and related lipids in human biological matrices: a review. J Chromatogr B Analyt Technol Biomed Life Sci. 2014;964:1-11.
Ceglarek U, Dittrich J, Becker S, Baumann F, Kortz L, Thiery J. Quantification of seven apolipoproteins in human plasma by proteotypic peptides using fast LC-MS/MS. Proteomics Clin Appl. 2013;11-12:794-801.
Brauer R, Leichtle AB, Fiedler GM, Thiery J, Ceglarek U. Preanalytical standardization of amino acid and acylcarnitine metabolite profiling in human blood using tandem mass spectrometry. Metabolomics. 2011;7:344-52.
Prodinger C, Bunse J, Krüger M, Schiefenhövel F, Brandt C, Laman JD, Greter M, Immig K, Heppner F, Becher B, Bechmann I. CD11c-expressing cells reside in the juxtavascular parenchyma and extend processes into the glia limitans of the mouse nervous system. Acta Neuropathol. 2011;121:445-58.
Streit WJ, Braak H, Xue QS, Bechmann I. Dystrophic (senescent) rather than activated microglial cells are associated with tau pathology and likely precede neurodegeneration in Alzheimer's disease. Acta Neuropathol. 2009;118:475-85.
Postdoc
Madlen Reinicke
|
Adresse (Büro):
|
Institut für Labormedizin, Klinische Chemie und Molekulare Diagnostik, Paul-List-Str. 13-15, Haus T, 04103 Leipzig
|
|
Telefon:
E-Mail:
|
0341 / 97 22481
|


Doktorandin
Judith Leyh
| Adresse (Büro): | Medizinische Fakultät, Institut für Anatomie, Liebigstraße 13, 04103 Leipzig |
|
Tel.: (Labor/ Büro):
E-Mail:
|
0341 / 97 22007
|
|
Thema des Promotionsprojekts:
|
Mikroglia
|
Doktorandin
Laura Plantera
| Adresse (Büro): | Medizinische Fakultät, Institut für Anatomie, Liebigstraße 13, 04103 Leipzig |
|
Tel.: (Labor/ Büro):
E-Mail:
|
0341 / 97 22007
|
|
Thema des Promotionsprojekts:
|
Mikroglia
|